光热疗法(PTT)是利用光敏剂在近红外(NIR)光照射下产生足够的热量来杀死肿瘤细胞并诱导抗肿瘤免疫,具有高选择性和低侵入性等特点,已成为一种有希望的有效癌症治疗方法。近红外吸收有机小分子可以在光子的激发下,通过分子内的非辐射跃迁途径产生热量而杀死肿瘤细胞,具有易于修饰、衍生、副作用小等特点,被认为是潜在的光热试剂。然而,目前常见的具有超过800 nm吸收波长的有机小分子光热剂的设计方法通常为:构建大的共轭体系和引入推拉电子结构。这种分子设计策略通常会导致近红外染料的。
近日,在国家自然科学基金和安徽省高峰学科建设的支持下,维多利亚3308老品牌功能共轭分子科研团队郝二红教授、焦莉娟教授,联合安徽中医药大学吴清华博士、尹登科教授,提出了一种通过调控“分子内”和“分子间”激子耦合实现近红外染料的可控聚集从而构建长波近红外光热试剂的设计方法,发展发了一种基于乙烯基桥联的aza-BODIPY二聚体类纳米光热试剂,其具有高光热转换效率,可在低功率的915 nm光激发下实现高效肿瘤光热治疗。
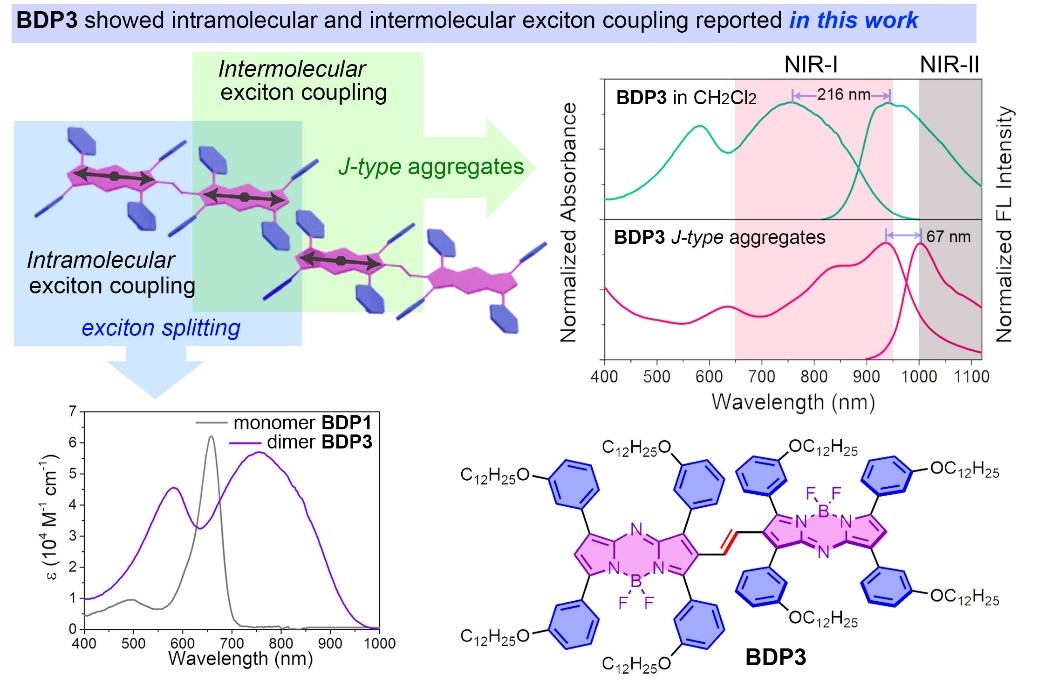
“双激子耦合”策略在肿瘤光热试剂设计中具有独特优势。当多聚体发色团的跃迁偶极矩在分子内和分子间都处于理想的排列位置时,激子不再局限于单个分子而是游离在整个发色团队列中,此时可获得聚集可控的(J-聚集)近红外光热试剂。处于聚集体状态下的光热试剂通常表现出优于单体的光物理性能,包括较大的吸收红移和优异的光/热稳定性。
作者构建的乙烯基桥联的aza-BODIPY二聚体发色团,由于其组成单体间的“偶极-偶极”相互作用其展现出强烈的分子内激子耦合,表现为吸收谱带的裂分和红移,并通过DFT计算、圆二色谱以及循环伏安法验证其分子内激子耦合的存在。而对其经过三嵌段共聚物F-127封装时,J-聚集体的形成使得其吸收和发射光谱的进一步红移(分别达到936 nm和1003 nm),同时也验证了其分子间激子耦合的存在。
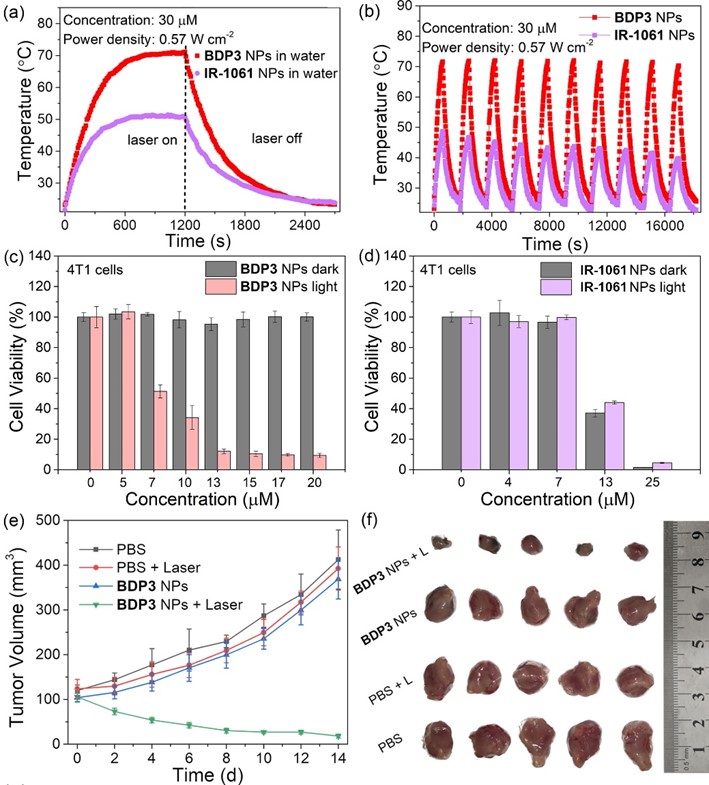
最终,该“双激子耦合”组装的光热试剂在肿瘤光热治疗中表现出高的光热转换效率(η = 60.3%)、优异的光热稳定性及良好的生物相容性等特点。小鼠活体显示该纳米光热试剂在915 nm低功率近红外激光其器的照射下,可有效实现肿瘤的完全消融。
这一研究工作通过调节分子内和分子间激子耦合实现近红外染料可控聚集,从而极大促进该有机染料自组装光热试剂的吸收和发射波长红移,提高了光热试剂光热转换效率和光热稳定性且成功应用于活体的光热治疗。这种策略有助于在实际应用中设计和制备高性能有机小分子光热试剂。相关结果近日发表在国际化学顶级期刊Angew. Chem. Int. Ed.(《德国应用化学》)上,论文第一作者是维多利亚3308老品牌博士研究生郭幸。
论文信息:
Xing Guo, Jinming Yang, Mao Li, Fan Zhang, Weibin Bu, Heng Li, Qinghua Wu, Dengke Yin, Lijuan Jiao, Erhong Hao. Unique Double Intramolecular and Intermolecular Exciton Coupling in Ethene-Bridged aza-BODIPY Dimers for High-Efficiency Near-Infrared Photothermal Conversion and Therapy, Angewandte Chemie International Edition, 2022, 61, e202211081.
论文链接:https://doi.org/10.1002/anie.202211081
















